Arkiv
Arkivnr.
RAPPORT
fra Gruppe nr __
:
til
OPPGAVE:
Reaksjonen mellom tert-butyl klorid og metanol skal undersøkes ved ulike reaksjonsbetingelser.
Forsøkene utføres i en CSTR reaktor. Omsetningen følges ved pH-meter. Reaktantene består av tert-butylklorid i metanol og vann i metanol.
Temperatur og oppholdstid varieres, mens startkonsentrasjon av tert-butyl klorid og molbrøken vann holdes konstant.
For samtlige reaksjonsbetingelser skal hastighetskonstanten for reaksjonen fra venstre mot høyre bestemmes, med antagelse om irreversibel reaksjon. Aktiveringsenergien skal også bestemmes (kun for versjon 3).
Litteratur:
Cropper, W.H., Spieth, F. og Olsen, A.R.,
J. Am. Chem. Soc., 76, 6248-6253 (1954)
.
Utlevert: Frist: Innlevert: Anm
Poeng
: Karakter: Sett:
Kinetic study in CSTR
Forsøksbetingelser
|
Forsøk nummer |
Temperatur [° C] |
Fødehastighet [ml/h] |
Konsentrasjon tBC [mol/dm3] |
Gruppe nummer |
|
1 |
30 |
600 |
0.025 |
- |
|
2 |
30 |
500 |
0.025 |
- |
|
3 |
30 |
400 |
0.025 |
- |
|
4 |
40 |
600 |
0.025 |
- |
|
5 |
40 |
500 |
0.025 |
- |
|
6 |
40 |
400 |
0.025 |
- |
|
7 |
45 |
600 |
0.025 |
- |
|
8 |
45 |
500 |
0.025 |
- |
|
9 |
45 |
400 |
0.025 |
- |
|
10 |
50 |
600 |
0.025 |
- |
|
11 |
50 |
500 |
0.025 |
- |
|
12 |
50 |
400 |
0.025 |
- |
|
13 |
30 |
600 |
0.035 |
- |
|
14 |
30 |
500 |
0.035 |
- |
|
15 |
30 |
400 |
0.035 |
- |
|
16 |
40 |
600 |
0.035 |
- |
|
17 |
40 |
500 |
0.035 |
- |
|
18 |
40 |
400 |
0.035 |
- |
|
19 |
45 |
600 |
0.035 |
- |
|
20 |
45 |
500 |
0.035 |
- |
|
21 |
45 |
400 |
0.035 |
- |
|
22 |
50 |
600 |
0.035 |
- |
|
23 |
50 |
500 |
0.035 |
- |
|
24 |
50 |
400 |
0.035 |
- |
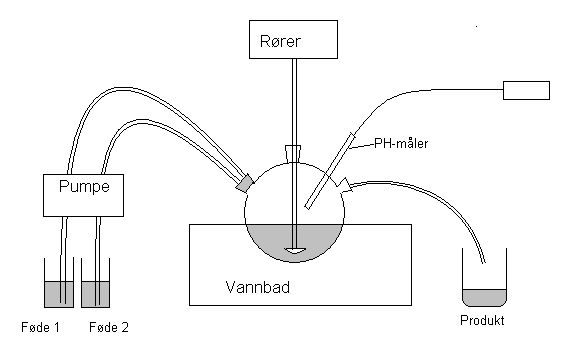
Apparaturskisse

Figur 1: Forsøksoppsett for kinetikkstudie i en CSTR reaktor.
Fremgangsmåte
Oppstart:
Bruksanvisning for vannbad og pH-elektroden skal finnes på labben.
Nytt forsøk:
Avslutning:
NB: Påse at alt elektrisk utstyr er avslått!!!
Teori
Hydrolyse av ter. butylklorid (bruttorx.):
Mekanisme for hydrolysen:
Splittelsen av tert. Butylklorid til karbokation og kloridion er det hastighetsbestemende trinn.
Splittelsen er unimolykulær, dvs. Hastighetsutrykket blir på formen :
r = k [tert.butylklorid]
Dvs. 1. Orden.
CSTR
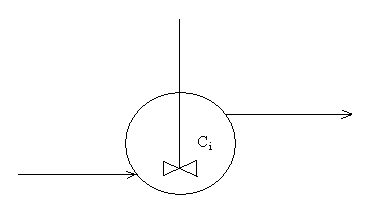
Figur 2 Kontinuerlig blandetanksreaktor
Massebalanse:
Qf (Ci)f - Qut (Ci)ut = - ri V
Qf = Qut gir:
(Ci)f - (Ci)ut = - ri V/Q = - ri ![]()
hvor
![]()
1. ordens reaksjon (r = k (Ci)ut ![]() );
);
(Ci)f - (Ci)ut = - k (Ci)ut ![]()
hastighetskonstanten: 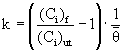
Aktiveringsenergi:
Arrhenius ligning ![]()
![]()
Plott av ln (k) mot 1/T gir en rett linje med stigningstall lik ![]() , som gir aktiveringsenergien.
, som gir aktiveringsenergien.
Utledninger og mer utfyllende teori se Scott Fogler.
Forbredelse til møte